Nouvelle formation : Ventilation & Qualité de l'air intérieur
En présentiel – durée : 8 heures
Le 23/05/2025 à partir de 07:30
Centre de formation Krakelshaff, Bettembourg
Gratuit pour les entreprises cotisantes au FONGECO
En savoir +

Dans le monde invisible des microorganismes qui nous entourent, les biofilms constituent une forme d'organisation particulièrement sophistiquée et résistante. Ces communautés microbiennes complexes représentent un défi considérable pour la gestion des réseaux d'eau, qu'ils soient destinés à la consommation humaine, aux usages industriels ou aux installations sanitaires. Le Laboratoire Luxembourgeois de Contrôle Sanitaire s'intéresse de près à cette problématique, car elle touche directement à la qualité de l'eau et, par conséquent, à la santé publique. Cet article examine en profondeur ce que sont les biofilms, leur mode de formation, les risques qu'ils représentent et les stratégies efficaces pour les contrôler dans les systèmes de distribution d'eau.
Un biofilm est une communauté microbienne complexe et organisée, englobée dans une matrice protectrice autoproduite et adhérant à une surface. Cette définition, bien que technique, masque une réalité biologique fascinante: les biofilms représentent l'une des formes de vie les plus anciennes et les plus résilientes sur notre planète.
Ces structures sont composées principalement de bactéries, mais peuvent également contenir des champignons, des algues, des protozoaires et d'autres micro-organismes. Ce qui caractérise fondamentalement un biofilm est sa matrice extracellulaire, composée de substances polymériques extracellulaires (EPS). Cette matrice, constituée majoritairement de polysaccharides, protéines, ADN extracellulaire et lipides, joue le rôle d'une véritable "colle biologique" permettant l'adhésion aux surfaces et la cohésion de l'ensemble de la structure.
La matrice représente généralement 50 à 90% de la masse totale du biofilm, les cellules microbiennes n'occupant qu'une fraction minoritaire de cet écosystème. Cette architecture particulière confère aux biofilms des propriétés remarquables, notamment une résistance accrue aux stress environnementaux et aux traitements antimicrobiens conventionnels.
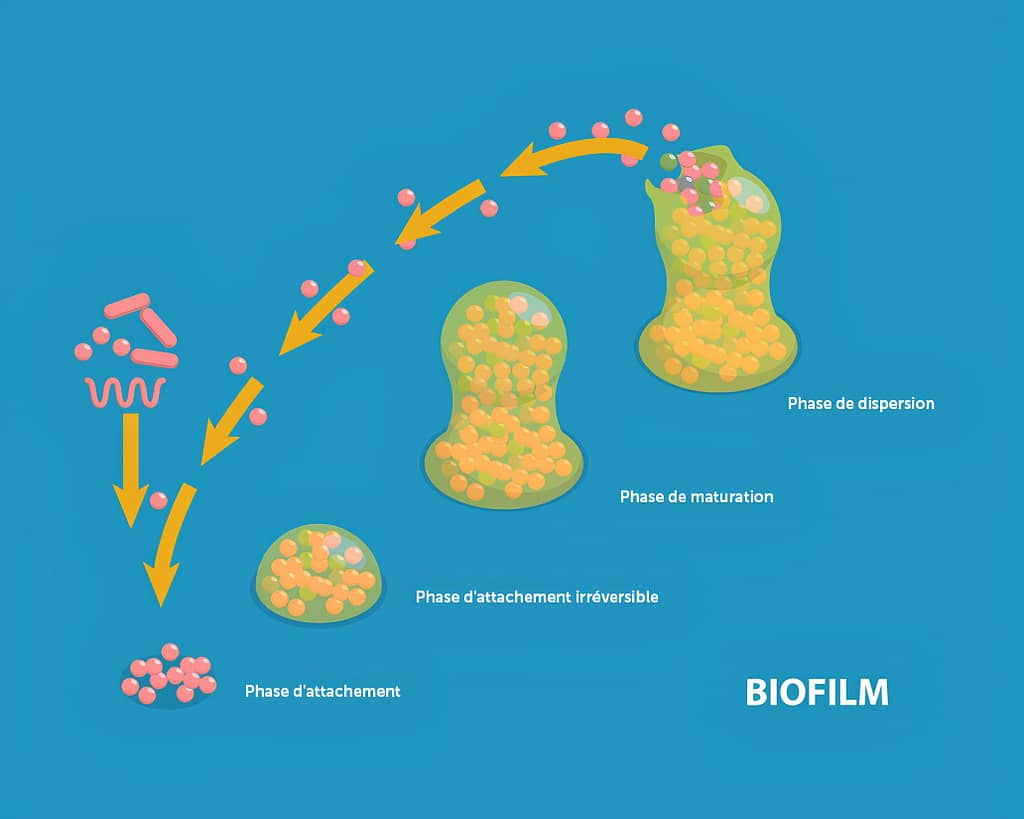
La formation d'un biofilm dans un réseau d'eau n'est pas un événement fortuit mais un processus séquentiel et dynamique qui se déroule en plusieurs étapes bien définies:
Tout commence par l'adhésion réversible de bactéries planctoniques (libres) à une surface. Dans les réseaux d'eau, cette surface peut être constituée de divers matériaux: acier inoxydable, cuivre, matières plastiques (PVC, polyéthylène), caoutchouc ou béton. Cette adhésion initiale est favorisée par les forces physiques comme les interactions électrostatiques et les forces de Van der Waals. À ce stade, l'attachement reste réversible, et les bactéries peuvent encore se détacher et retourner à l'état planctonique.
Les bactéries qui persistent sur la surface commencent à produire des substances polymériques extracellulaires, principalement des exopolysaccharides. Cette production transforme l'attachement initial, qui était réversible, en une adhésion permanente. Les bactéries sont désormais ancrées solidement à la surface et entament une modification profonde de leur métabolisme et de l'expression de leurs gènes.
Une fois l'adhésion irréversible établie, le biofilm entre dans une phase de croissance et de maturation. Les bactéries se multiplient et continuent de produire la matrice extracellulaire. La structure devient de plus en plus complexe, avec l'apparition de microcolonies et de canaux aqueux qui permettent la circulation des nutriments et l'évacuation des déchets métaboliques. Cette architecture tridimensionnelle est souvent comparée à une ville microbienne avec ses "rues" et ses "bâtiments".
Le cycle de vie du biofilm se complète par une phase de dispersion, durant laquelle certaines cellules se détachent pour coloniser de nouvelles surfaces. Ce détachement peut être actif (programmé génétiquement) ou passif (résultant de forces externes comme le flux d'eau). Les cellules dispersées retrouvent leur état planctonique et peuvent initier la formation de nouveaux biofilms ailleurs dans le réseau.
Les biofilms présents dans les réseaux d'eau constituent de véritables écosystèmes microbiens caractérisés par une biodiversité remarquable. Leur composition varie considérablement en fonction de nombreux facteurs environnementaux, notamment la température, le pH, la concentration en nutriments et la nature du matériau support.
Dans les réseaux d'eau potable, on retrouve fréquemment des bactéries appartenant aux genres Pseudomonas, Sphingomonas, Methylobacterium, Acinetobacter, Mycobacterium et Legionella. Les réseaux d'eau chaude sanitaire, en raison de leurs conditions thermiques particulières, favorisent le développement de bactéries thermophiles, avec une préoccupation particulière pour Legionella pneumophila, l'agent responsable de la légionellose.
À côté de ces bactéries, les biofilms peuvent également abriter des protozoaires comme Acanthamoeba et Naegleria, qui non seulement représentent un danger direct pour la santé, mais peuvent aussi servir d'hôtes à d'autres pathogènes comme Legionella, les protégeant ainsi des traitements désinfectants.
Il est important de souligner que ces microorganismes ne coexistent pas simplement les uns à côté des autres, mais établissent de véritables relations d'interdépendance. Certaines espèces modifient l'environnement local, créant des conditions favorables à l'implantation d'autres espèces. Ce phénomène, connu sous le nom de succession écologique, contribue à la complexification progressive du biofilm et à sa résilience accrue face aux perturbations environnementales.
De nombreux paramètres influencent la formation et le développement des biofilms dans les systèmes de distribution d'eau. Leur compréhension est essentielle pour mettre en place des stratégies de prévention efficaces.
Dans les réseaux d'eau, les nutriments disponibles pour les microorganismes proviennent principalement de la matière organique dissoute. Cette matière organique peut être naturellement présente dans l'eau brute (composés humiques, protéines, polysaccharides) ou être introduite lors des traitements (additifs, floculants). Même à des concentrations très faibles (quelques microgrammes par litre), ces nutriments suffisent à soutenir le développement de biofilms.
La température exerce une influence considérable sur l'activité métabolique des microorganismes et, par conséquent, sur la cinétique de formation des biofilms. Dans les réseaux d'eau froide, les températures inférieures à 20°C ralentissent généralement la croissance microbienne, tandis que dans les réseaux d'eau chaude, les températures comprises entre 25°C et 45°C créent des conditions idéales pour le développement de nombreux microorganismes, notamment Legionella pneumophila qui prolifère optimalement entre 35°C et 42°C.
En savoir plus sur légionellose ?
L'acidité de l'eau influence directement la physiologie des microorganismes et la stabilité de leur matrice extracellulaire. La plupart des bactéries rencontrées dans les réseaux d'eau se développent préférentiellement à des pH proches de la neutralité (6,5-8,5). De même, la présence de certains ions métalliques (fer, manganèse) peut stimuler la croissance bactérienne, tandis que d'autres (cuivre, argent) exercent un effet inhibiteur.
Le régime d'écoulement de l'eau joue un rôle déterminant dans la formation des biofilms. Les zones à faible vitesse d'écoulement ou stagnantes (bras morts, réservoirs, chauffe-eau) favorisent l'adhésion des bactéries et l'accumulation de nutriments, créant des conditions propices au développement des biofilms. À l'inverse, les zones à fort cisaillement hydraulique limitent l'attachement initial des microorganismes mais peuvent contribuer à la dispersion des biofilms déjà formés.
Les différents matériaux utilisés dans la construction des réseaux d'eau présentent des susceptibilités variables à la colonisation microbienne. Les matériaux polymères (PVC, polyéthylène) peuvent relarguer des composés organiques servant de nutriments aux microorganismes. L'acier inoxydable, bien que généralement plus résistant à la formation de biofilms, peut présenter des zones de corrosion créant des micro-niches favorables à l'adhésion bactérienne. Le cuivre possède des propriétés antimicrobiennes intrinsèques mais devient moins efficace avec le temps en raison de la formation d'une couche d'oxydation.
L'efficacité des désinfectants utilisés pour le traitement de l'eau (chlore, chloramine, dioxyde de chlore) diminue progressivement à mesure que l'on s'éloigne du point d'injection, en raison de leur consommation par la matière organique et de leur dégradation naturelle. Cette diminution du pouvoir désinfectant favorise la prolifération microbienne dans les parties distales du réseau.
Les biofilms présents dans les systèmes de distribution d'eau ne constituent pas seulement un problème technique, mais représentent également un enjeu majeur de santé publique et de sécurité sanitaire. Les risques qu'ils engendrent sont multiples et concernent différents aspects de la qualité de l'eau.
Le danger le plus évident lié aux biofilms concerne leur capacité à héberger des microorganismes pathogènes. Plusieurs bactéries potentiellement dangereuses pour l'homme trouvent dans les biofilms un environnement protecteur idéal:
Les biofilms peuvent significativement dégrader les qualités organoleptiques de l'eau, rendant celle-ci impropre à la consommation même en l'absence de risque sanitaire immédiat:
Au-delà des aspects sanitaires, les biofilms engendrent de nombreux problèmes techniques qui affectent le fonctionnement des réseaux d'eau:
La remarquable résistance des biofilms aux agents antimicrobiens conventionnels constitue l'un des défis majeurs pour leur élimination des réseaux d'eau. Cette résistance, qui peut être jusqu'à 1000 fois supérieure à celle des bactéries planctoniques de la même espèce, repose sur plusieurs mécanismes complémentaires.
La matrice d'exopolymères qui entoure les microorganismes dans le biofilm forme une barrière physique limitant la pénétration des agents antimicrobiens. Cette matrice, composée principalement de polysaccharides, protéines et ADN extracellulaire, agit comme un filtre sélectif:
Au sein d'un biofilm mature, les microorganismes présentent une remarquable hétérogénéité physiologique qui contribue à leur survie collective face aux stress environnementaux:
Les microorganismes organisés en biofilm développent des stratégies adaptatives collectives qui renforcent leur résistance face aux agressions externes:
La détection précoce des biofilms dans les réseaux d'eau constitue un enjeu crucial pour la mise en œuvre de stratégies de lutte efficaces. Plusieurs approches complémentaires sont disponibles, chacune présentant des avantages et des limitations spécifiques.
Les techniques traditionnelles de culture microbienne demeurent largement utilisées pour l'analyse de routine des eaux de distribution:
Pour pallier les limitations des méthodes conventionnelles, diverses techniques et moléculaires ont été développées:
La PCR quantitative (qPCR) permet de détecter et quantifier des séquences d'ADN spécifiques de microorganismes cibles, même présents en très faible concentration. Cette approche est particulièrement utile pour la détection de pathogènes difficiles à cultiver comme Legionella pneumophila.
Le séquençage à haut débit (NGS - Next Generation Sequencing) offre une vision exhaustive de la diversité microbienne présente dans les biofilms, permettant d'identifier l'ensemble des espèces présentes et leurs proportions relatives.
L'analyse des biofilms directement dans les réseaux présente un intérêt majeur pour comprendre leur développement dans les conditions réelles d'exploitation:
La maîtrise des biofilms dans les réseaux d'eau nécessite une approche multifactorielle combinant mesures préventives et traitements curatifs. Une stratégie efficace doit prendre en compte les spécificités de chaque installation et s'adapter aux contraintes opérationnelles et réglementaires.
Une conception hydraulique optimisée constitue la première ligne de défense contre le développement des biofilms:
Plusieurs approches physiques peuvent être mises en œuvre pour déstabiliser ou éliminer les biofilms déjà formés:
Les traitements chimiques demeurent incontournables pour la désinfection des réseaux d'eau, mais leur efficacité contre les biofilms établis reste variable:
La gestion des risques liés aux biofilms dans les réseaux d'eau s'inscrit dans un cadre réglementaire de plus en plus exigeant, tant au niveau européen que national.
La Directive européenne 2020/2184 relative à la qualité des eaux destinées à la consommation humaine, qui remplace la directive 98/83/CE, renforce les exigences en matière de surveillance microbiologique des réseaux d'eau potable. Elle introduit notamment une approche fondée sur les risques pour la gestion de la sécurité sanitaire de l'eau, incluant explicitement les risques liés à la distribution.
Au Luxembourg, le règlement grand-ducal du 7 octobre 2002 relatif à la qualité des eaux destinées à la consommation humaine définit les exigences de qualité microbiologique applicables à l'eau potable et impose aux distributeurs la mise en place de programmes de surveillance adaptés.
Pour les établissements recevant du public, en particulier les établissements de santé, des dispositions spécifiques concernant la prévention du risque lié à Legionella sont également applicables, notamment la circulaire du ministère de la Santé du 23 décembre 2022 relative à la surveillance de la qualité de l'eau dans les établissements sanitaires.
Les biofilms représentent un défi majeur pour la gestion des réseaux d'eau, avec des implications importantes en termes de santé publique, de qualité de service et de coûts d'exploitation. Leur complexité biologique et leur remarquable capacité d'adaptation aux stress environnementaux en font des adversaires redoutables, nécessitant des stratégies de lutte multifactorielles et évolutives.
La compréhension des mécanismes de formation et de résistance des biofilms a considérablement progressé ces dernières années, ouvrant la voie à des approches préventives plus efficaces. Parallèlement, le développement de nouvelles techniques analytiques permet une détection plus précoce et plus précise de ces structures microbiennes, facilitant la mise en œuvre de mesures correctives ciblées.
La présence de biofilms peut se manifester par divers signes, notamment une diminution de l'efficacité des désinfectants, des problèmes récurrents de qualité microbiologique de l'eau, des odeurs ou goûts inhabituels, ou encore une accélération des phénomènes de corrosion. Une analyse microbiologique approfondie, combinant cultures traditionnelles et techniques moléculaires modernes, permet de confirmer leur présence et d'évaluer leur composition.
Certains filtres domestiques, notamment ceux équipés de membranes à ultrafiltration ou de charbon actif, peuvent retenir une partie des micro-organismes libérés par les biofilms. Cependant, ces dispositifs nécessitent un entretien rigoureux, car ils peuvent eux-mêmes devenir des sites propices au développement de biofilms en l'absence de maintenance régulière. Pour une protection optimale, il convient de respecter scrupuleusement les recommandations du fabricant concernant le remplacement des cartouches filtrantes.
Aucun matériau n'est totalement réfractaire à la formation de biofilms, mais certains présentent des propriétés limitant l'adhésion microbienne. Les matériaux incorporant des agents antimicrobiens comme le cuivre ou l'argent, ou dotés de surfaces hydrophobes ou superhydrophiles, montrent une réduction significative de la colonisation bactérienne. Les revêtements innovants à base de nanoparticules ou de polymères antibactériens constituent également des solutions prometteuses, bien que leur durabilité à long terme reste à confirmer.
Effectivement, les biofilms peuvent influencer la concentration en métaux lourds dans l'eau de deux manières. D'une part, en favorisant la corrosion des canalisations métalliques, ils peuvent augmenter la libération de plomb, cuivre ou fer dans l'eau. D'autre part, certains micro-organismes présents dans les biofilms possèdent la capacité d'accumuler des métaux lourds, puis de les relarguer dans des conditions environnementales spécifiques, créant potentiellement des pics de contamination intermittents particulièrement difficiles à détecter lors des contrôles ponctuels.
La fréquence optimale des opérations de nettoyage dépend de nombreux facteurs, incluant la qualité de l'eau brute, les matériaux constitutifs du réseau, les températures de fonctionnement et les protocoles de désinfection en place. Dans les environnements sensibles comme les établissements de santé, des interventions semestrielles peuvent être nécessaires, tandis que pour les réseaux domestiques bien entretenus, un nettoyage annuel peut suffire. Une approche basée sur l'analyse des risques, incluant une surveillance microbiologique régulière, permet d'adapter la fréquence des interventions aux spécificités de chaque installation.
Source :
https://environnement.public.lu/fr/waasser/eau-potable/qualite-et-surveillance.html
https://emwelt.lu/waasser
https://www.encyclopedie-environnement.org/sante/biofilms-bacteriens/

Nouvelle formation : Ventilation & Qualité de l'air intérieur
En présentiel – durée : 8 heures
Le 23/05/2025 à partir de 07:30
Centre de formation Krakelshaff, Bettembourg
Gratuit pour les entreprises cotisantes au FONGECO
En savoir +